Contaminación microbiológica
La contaminación microbiológica se refiere a la introducción involuntaria o no intencionada de microorganísmos infecciosos como las bacterias, levaduras, mohos, hongos, virus, priones, protozoos o de sus toxinas y/o subproductos.1,2
Una infección nosocomial, también denominada «infección adquirida en el hospital ó intra-hospitalaria» se define como:
Una infección que se produce en un paciente de un hospital u otro centro de salud en quien la infección no estaba presente en el momento del ingreso. Esto incluye infecciones adquiridas en el hospital pero que aparecen después del alta, y también infecciones laborales entre el personal del centro»3
Tipos de microorganismos patógenos
Existe una amplia gama de microorganismos, que pueden ocasionar contaminación, y por tanto, infecciones. En estos grupos, existen varios tipos diferentes de patógenos:
Bacterias
Bacterias: son microorganismos con un tamaño de hasta 5 µm y representan el grupo más importante de patógenos cuando se habla de contaminación microbiológica. De acuerdo con la constitución de su pared celular, las bacterias pueden dividirse en grampositivas y gramnegativas.
Además, las bacterias pueden distinguirse del siguiente modo:
Bacterias «comensales»:
pertenecen a la flora normal de los seres humanos sanos. Generalmente son inofensivas para las personas sanas o incluso tienen una función protectora significativa al evitar la colonización por parte de microorganismos patógenos. No obstante, algunas bacterias comensales pueden causar infección si el huésped natural está inmunodeprimido o si penetran dentro del tejido del huésped.3
Bacterias patógenas:
tienen una virulencia mayor y causan infecciones independientemente del estado del huésped.3
Virus
Virus: elementos biológicos subcelulares con un tamaño de entre 20 y 200 nm. Existen con y sin envoltura (estas derivan principalmente de las membranas del huésped que cubren al virus) y pueden causar infecciones graves.3
Priones
Priones: partículas proteicas infecciosas. Son los patógenos más pequeños, con un tamaño por debajo de los 5 nm.
Tanto los priones como los virus son partículas sin metabolismo propio y, por tanto, no pueden considerarse organismos vivos. Para la reproducción, dependen del metabolismo de un organismo huésped.3
Los hongos, levaduras y protozoos
Los hongos, levaduras y protozoos, con hasta 200 µm de diámetro, son tres grupos adicionales de fuentes de infección.3
Definición de infección del torrente sanguíneo relacionada con el catéter
La definición de CR-BSI ayuda a decidir si un catéter es la fuente principal de bacteriemia en un paciente. Incluyen infecciones en el sitio de salida o en el túnel y se definen como:
- Eritema, enrojecimiento o inflamación dentro de los 2 cm del sitio de salida del catéter, con o sin infección concomitante del torrente sanguíneo.
- Para las infecciones del túnel, la presencia de sensibilidad, eritema o induración de la zona >2 cm del sitio del catéter a lo largo del tracto subcutáneo de un catéter con túnel en ausencia de infección concomitante del torrente sanguíneo, según sea necesario.5
La contaminación microbiológica es peligrosa para los pacientes sobre todo cuando afecta al tratamiento parenteral y a los catéteres intravenosos usados. En este caso, los patógenos pueden alcanzar directamente la circulación general y causar infección del torrente sanguíneo relacionada con el catéter o viajar a diferentes órganos e inducir insuficiencia orgánica.
Por tanto, es crucial la prevención de las infecciones del torrente sanguíneo relacionadas con los catéteres. A mediados de los 90, los Centros para el Control y la Prevención de Enfermedades (CDC) publicaron una definición estándar para las infecciones del torrente circulatorio relacionadas con los catéteres, que es la más aceptada.6
Las infecciones bacterianas pueden tratarse en su mayoría con antibióticos. Sin embargo, hay casos en los que es extremadamente difícil o incluso imposible porque las bacterias se han vuelto multirresistentes a fármacos. Frente a la mayoría de los virus y todas las enfermedades priónicas, tampoco hay disponibles fármacos eficaces. Por tanto, resulta crucial la prevención de estas infecciones.
Infecciones de Staphylococcus Aureus Resistente a la Meticilina (MRSA)
La infección por Staphylococcus Aureus Resistente a la Meticilina es un problema grave de salud a nivel mundial. MRSA se define como cualquier cepa de Staphylococcus Aureus que haya desarrollado resistencia a los antibióticos betalactámicos, lo que incluye las penicilinas (meticilina, dicloxacilina, nafcilina, oxacilina, etc.) y las cefalosporinas.
De acuerdo al Centro para el Control y la Prevención de Enfermedades (CDC), en la actualidad, alrededor de un 1 % de todas las infecciones por estafilococos y más del 50 % de las infecciones por estafilococos asociadas a la atención sanitaria son MRSA. Después de Staphylococcus epidermidis, Staphylococcus aureus es el segundo patógeno más frecuente que causa infecciones asociadas con la atención sanitaria en los Estados Unidos, y el 49 % de dichas infecciones las produce la bacteria MRSA altamente resistente a los antibióticos.9
Una cepa llamada USA100 es el tipo más frecuente de MRSA implicada en las infecciones asociadas con la atención sanitaria de los hospitales de los EE. UU.8 MRSA es especialmente problemático en hospitales y residencias de ancianos. Los pacientes con heridas abiertas, dispositivos invasivos y sistemas inmunológicos debilitados están en un riesgo mayor de infección que el público en general. En los Estados Unidos, cada año se infectan con Staphylococcus Aureus más de 290.000 pacientes hospitalizados. De estas infecciones de estafilococos, aproximadamente 126.000 están relacionadas con MRSA.9
“Las infecciones nosocomiales están muy extendidas. Son importantes contribuyentes a la morbilidad y mortalidad, y serán aún más importantes como un problema de salud pública con un mayor impacto económico y humano debido a:
- Incremento del número y aglomeración de personas.
- Alteraciones más frecuentes de la inmunidad (edad, enfermedad y tratamientos)
- Nuevos Microorganismos.
- Aumento de la resistencia de las bacterias a los antibióticos existentes."4
Bacterias multiresistentes
La multirresistencia a fármacos es una condición que permite al microorganismo causante de una enfermedad resistir distintos fármacos o productos químicos de una amplia variedad de estructuras y funciones dirigidas a erradicar al microorganismo.10
Los organismos más importantes multirresistentes a fármacos son:
- Staphylococcus Aureus Resistente a la Meticilina (MRSA)
- Enterococus Resistentes a Vancomicina (ERV)
- Bacterias Gram Negativas que producen β-lactamasas de amplio espectro (BLAE)
- Gran Negativas que producen Carbapenemasa de Klebsiella Pneumoniae (CKP)
- Acinetobacter Baumannii Resistente a Imipenem
- Pseudomonas Aerginosa Resistente a Imipenem
- Mycobacterium Tuberculosis Multirresistente a fármacos (TB-MR) y Mycobacterium Tuberculosis Extremadamente Multirresistente (TB-XMR) a fármacos
¿Sabes que?

(1) Pittet, Didier; „Adapt to adopt; TEDxPlaceDesNations“, under https://www.youtube.com/watch?v=5tgH0uTqqcE (accessed at 2 May 2016)
(2) WHO; Presentation: WHO_Facts_DRT661; „Health-Care Associated Infection and Hand Hygiene Improvement - Slides for the Hand Hygiene Co-ordinator of the WHO“ http://www.who.int/gpsc/country_work/gpsc_ccisc_fact_sheet_en.pdf
Causas
En general, la contaminación se produce si cualquier parte de un sistema, producto o medicamento entra en contacto con microorganismos patógenos en un punto en el que debería ser estéril. Por ejemplo, si un instrumento quirúrgico está contaminado con patógenos, el resultado podría ser una infección de la herida quirúrgica.
Posibles fuentes, rutas de entrada y formas de transmisión
Hay varias fuentes, vías de entrada y formas posibles de transmisión.
- Fuentes: Flora natural de la piel, superficies, elementos y/o equipos médicos contaminados
- Puertas de entrada: Orificios naturales del organismo o aberturas corporales artificiales debidas a intervenciones quirúrgicas, lesiones o enfermedades
- Transmisión directa a través del contacto o la diseminación de gotas
- Transmisión indirecta a través de superficies o instrumentos
- Transmisión indirecta a través de vectores, mosquitos, moscas, ratas que transmiten la infección
- Transmisión indirecta a través de un huésped intermediario [p. ej., humano, animal o insecto, p. ej., transmisión del paludismo a través de los mosquitos].
En el entorno sanitario, las vías importantes de contaminación son las manos del personal sanitario y las gotas del aire.
Infecciones relacionadas a la Terapia de Infusión
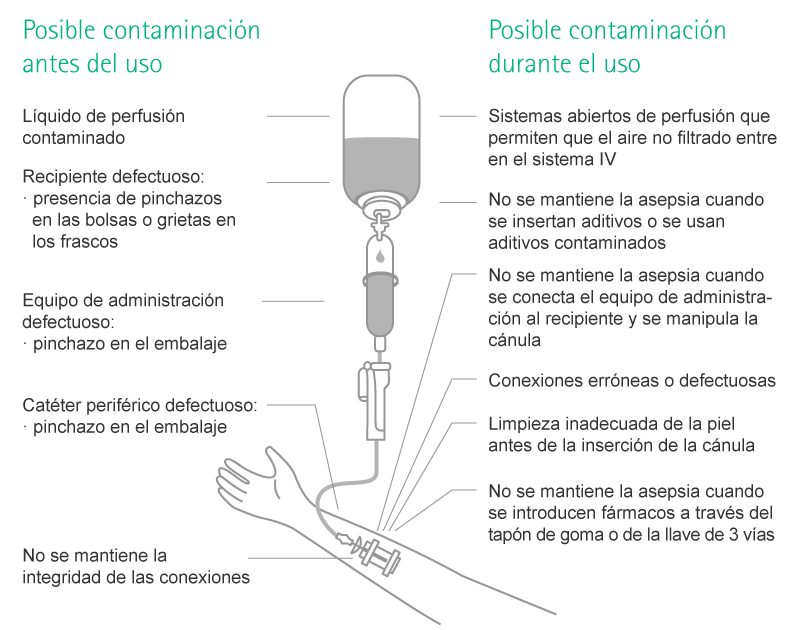
Puede producirse contaminación en los entornos de infusión cuando los patógenos se transportan al interior del sistema de infusión, lo que tiene lugar sobre todo durante la manipulación.
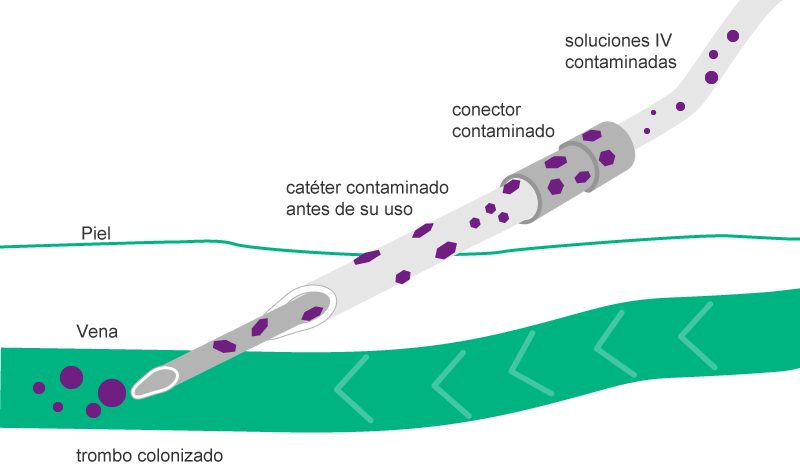
En referencia a las infecciones asociadas a la infusión, hay dos vías separadas: la vía extra e intraluminal.11,12,13 La contaminación intraluminal es la consecuencia del manejo inadecuado del sistema de infusión, p. ej., del conector del catéter en el momento de la conexión y desconexión del equipo de administración. Este es el origen más frecuente de las infecciones de los catéteres después de la primera semana de su colocación.11,12,13
La contaminación extraluminal del catéter es consecuencia de la invasión bacteriana a partir del punto de entrada del catéter a lo largo de la superficie externa del mismo y conduce a la bacteriemia, sobre todo durante la semana posterior a la colocación del catéter.11,12,13
Consecuencias para la salud
Las infecciones nosocomiales se producen en todo el mundo y afectan tanto a los países desarrollados como a aquellos en vías de desarrollo. Las infecciones adquiridas en los entornos sanitarios están entre las principales causas de muerte y de aumento de la morbilidad entre los pacientes hospitalizados. Suponen una carga significativa, tanto para el paciente como para la salud pública. Un estudio de prevalencia realizado bajo el auspicio de la OMS (Organización Mundial de la Salud) en 55 hospitales de 14 países que representaban a 4 regiones Europa, Mediterráneo Oriental, Sudeste Asiático y Pacífico Occidental, mostró un promedio del 8,7 % de pacientes de los hospitales tenían infecciones nosocomiales.
A nivel global, más de 1,4 millones de personas sufren complicaciones infecciosas adquiridas en el Hospital.15
Este suceso, representa el 7% en países desarrollados y el 10% en países en vías de desarrollo. Como estas infecciones ocurren durante la estadía en el hospital, causan aumento de los días de hospitalización, discapacidad y carga económica.16
Las infecciones nosocomiales más frecuentes son las infecciones de las heridas quirúrgicas, del tracto urinario y del tracto respiratorio bajo.
Varios estudios, incluyendo el de la OMS, han mostrado que la mayor prevalencia de las infecciones nosocomiales se produce en las unidades de cuidados intensivos y en las salas de cirugía aguda y de ortopedia. Las tasas de infección son mayores entre los pacientes con mayor susceptibilidad, debido a la edad avanzada, la enfermedad subyacente o su sistema inmunológico debilitado a causa de la quimioterapia.3
Puede producirse contaminación y la posterior infección a nivel local o sistémico.
- En caso de infección local, pueden producirse infecciones de las heridas quirúrgicas, irritaciones de la piel e infecciones del lugar de entrada del catéter.
- En caso de inflamación sistémica con patógenos que alcancen la circulación general, pueden producirse septicemia, sepsis y shock séptico, así como también, los patógenos pueden transportarse a los órganos o extremidades y ocasionar infección e insuficiencia orgánicas, así como también endocarditis u osteomielitis, que podrían dar lugar a la amputación.17,18
En todos los casos será necesario realizar múltiples pruebas diagnósticas y tratamientos adicionales, que pueden conducir molestias, estrés emocional para el paciente, potenciales efectos secundarios y dolor. Y en algunos casos, podrían incluso conducir a trastornos incapacitantes que reducen la calidad de vida.
Adicionalmente, puede prolongarse la estancia hospitalaria. Un estudio19 mostró que el aumento general en la duración de la hospitalización para los pacientes con infecciones de las heridas quirúrgicas era de 8,2 días, oscilando desde los 3 días para ginecología hasta los 9,9 días para cirugía general y 19,8 días para cirugía ortopédica.
El estudio de prevalencia de puntos EPIC II de infección en pacientes en estado crítico realizado el 8 de mayo de 2007 evaluó el papel de la resistencia a la meticilina en la supervivencia de los pacientes con infección por Staphylococcus aureus. En el día del estudio, se clasificó como infectados a 7.087 (51 %) de los 13.796 pacientes. Hubo 494 pacientes con infecciones por MRSA y 505 pacientes con infecciones por MSAS (Staphylococcus Aureus Susceptible a la Meticilina). Las tasas de mortalidad en la UCI fueron del 29,1 % y 20,5 % respectivamente (P < 0,01) y las correspondientes tasas de mortalidad en el hospital fueron del 36,4 % y 27,0 % (P < 0,01). El análisis multivariado de la mortalidad hospitalaria para las infecciones por MRSA mostró un cociente de probabilidad (CP) de 1,46 (IC del 95 % 1,03-2,06) (P=0,03).
Por lo tanto, en los pacientes de la UCI, la infección por MRSA se asocia de forma independiente con al menos un incremento del 50 % en la probabilidad de muerte hospitalaria en comparación con la infección por MSAS.20 Otros han encontrado que la tasa de mortalidad para las infecciones del torrente sanguíneo se sitúa entre el 10 y 25 %, y que el shock séptico era incluso mayor, entre un 40 y un 60 %.21 Por tanto, las infecciones nosocomiales son una de las principales causas de muerte.22
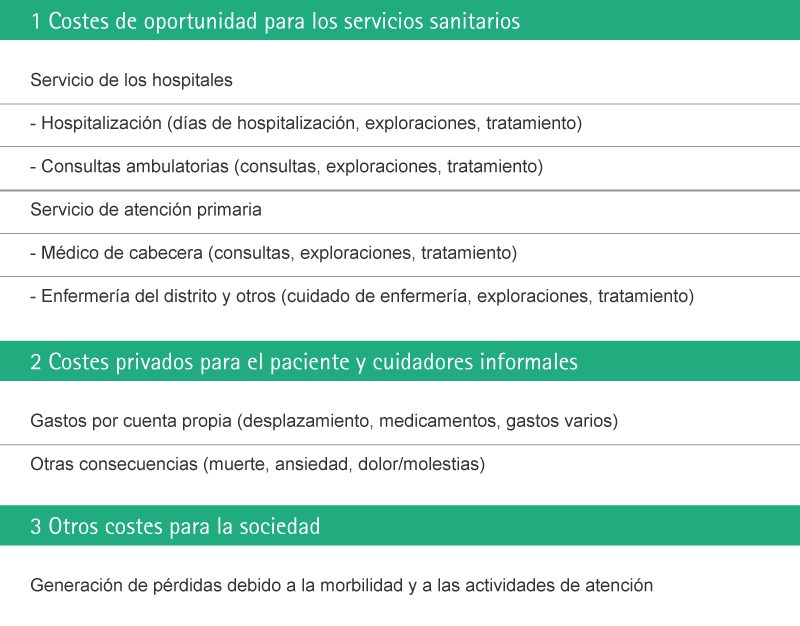
Consecuencias económicas
La prevención de la contaminación de los dispositivos médicos y de las soluciones de infusión, y por tanto, la prevención de la infección y sepsis graves, es de suma importancia en el entorno hospitalario y puede dar lugar a ahorros tangibles para el proveedor sanitario. En el caso de sepsis grave, que requiere tratamiento completo en la UCI, un hospital puede ahorrar hasta 56.670 € por caso individual.
Impacto económico de las infecciones nosocomiales
Uslusoy y colaboradores17 han estimado que más de dos millones de casos de infecciones nosocomiales al año (5,7 infecciones por cada 100 ingresos) con un coste medio de 13.973 €. Afirman que en caso de MRSA, este coste puede llegar a los 35.367 €.
Las infecciones nosocomiales se producen en más de dos millones de hospitalizaciones al año38 y los costes económicos de éstas infecciones nosocomiales son considerables.37,39 La mayor duración de la estancia hospitalaria es el mayor contribuyente a dichos costes.6,19,40 Además, el aumento de la morbilidad y del coste total por paciente que ha sobrevivido es de aproximadamente 40.000 €.40,41
En su estudio que evalúa el resultado de las infecciones relacionadas con los catéteres intravenosos en pacientes en estado crítico, Rello y colaboradores encontraron que entre los supervivientes, la estancia hospitalaria se prolongó en 19,6 días.42 Este coste añadido de 3.124 € por episodio de infección relacionada con el catéter basado únicamente en los días adicionales de hospitalización, sin tener en cuenta los gastos de diagnóstico y tratamiento.
Vandijck y colaboradores investigaron el coste diario del tratamiento antimicrobiano en pacientes con infección del torrente sanguíneo adquirida en la UCI.43 El coste medio diario general del tratamiento antimicrobiano fue de 114.25 € por paciente. Puesto que la duración medio del tratamiento antimicrobiano para los pacientes infectados oscila desde los 7 a los 14 días, el coste total de dicho tratamiento por paciente varió desde los 800 € y 1.200 €. En casos especiales de infecciones por bacterias resistentes a los antibióticos habituales, se ha identificado un posible coste adicional de 8.480 € por paciente (aproximadamente 5.000 €).44
Una revisión sistemática de la literatura que abarcaba desde 1990 hasta 2000 calculó los siguientes costes promedio atribuibles (costes calculados con un grupo control de pacientes y que incluía solamente los costes directos resultantes de las infecciones nosocomiales) para el hospital debido a infecciones nosocomiales:
- Infección nosocomial media, coste medio = 13.973 $
- Infección del torrente sanguíneo, coste medio = 36.441 $
- Infecciones de Staphylococcus Aureus Resistente a la Meticilina (MRSA), coste medio = 35.367 $
- Infección de la herida quirúrgica, coste medio = 25.546 $
- Neumonía, coste medio = 9.969 $
Para las siguientes infecciones, no se realizaron estudios para determinar los costes atribuibles pero se conocen los costes de tratamiento:
- Infección urinaria, coste medio = $ 1.008
- Infección por Virus de Varicela Zóster = $ 27.377
- Tuberculosis, coste medio = $ 61.446
- Sarampión, coste medio = $ 41.087
Desde la revisión de la literatura, Roberts y colaboradores crearon un modelo económico basado en una muestra de pacientes del Hospital Universitario de Rush que controlaba la intensidad de la enfermedad y la estadía en la unidad de cuidados intensivos para calcular los costes promedio atribuibles de una infección nosocomial promedio, dando como resultado 15.275 $.41,45
Otro estudio reciente utilizó datos nacionales y un método de emparejamiento de casos y controles para supervisar el/los grupo/s relacionado/s con el diagnóstico, el sexo, raza, edad y comorbilidad para calcular que los costes promedio en exceso atribuibles al indicador nacional «infección seleccionada debido a la asistencia sanitaria» son de 38.656 $.42
Los costes de un brote de infección nosocomial pueden alcanzar fácilmente millones de dólares.46
La prolongación del ingreso no solamente aumenta los costes directos para los pacientes o contribuyentes, sino también los costes indirectos debidos a la pérdida de trabajo. La necesidad de aislamiento y el uso adicional del laboratorio y de otros estudios diagnósticos también contribuyen al incremento de los costes.
Las infecciones adquiridas en el hospital se suman al desequilibrio entre la asignación de recursos para la atención primaria y secundaria al desviar los escasos fondos para el tratamiento de trastornos potencialmente evitables.
El 1 de octubre de 2008, los Centros para los servicios de Medicare y Medicaid (CMS) decidieron dejar de pagar a los hospitales por el tratamiento necesario debido a «complicaciones evitables», trastornos que son resultado de errores médicos o tratamiento inadecuado y que se puede pensar de forma razonada que deben evitarse.47
Incluso los episodios no mortales de contaminación microbiológica condujeron a gastos adicionales para el diagnóstico (p. ej., cultivos sanguíneos, pruebas analíticas, radiografías) e intervenciones terapéuticas (p. ej., antibióticos, catecolaminas), así como también una prolongación de la estancia en el hospital y el coste medio diario 48,49,50 del tratamiento clínico esperado.
Costos potenciales asociados a riesgos
Generalmente, a los pacientes con infecciones graves y sepsis se les trata en las unidades de cuidados intensivos (UCI) donde puede proporcionarse supervisión estrecha y tratamiento de cuidados intensivos por parte de profesionales especializados y con equipos adecuados. Los costes de personal representan entre el 40 % y más del 60 % del presupuesto total de la UCI. Debido a la elevada proporción de costes fijos en el tratamiento de la UCI, los costes totales del mismo dependen principalmente de la duración de la estancia en la UCI (DI-UCI). El coste total promedio por día de UCI se estima en aproximadamente 1.200 € para los países con un sistema sanitario altamente desarrollado (en base a varios estudios realizados entre 1989 y 2001, y convertidos a las tasas de cambio de 2003).
Estos pacientes necesitan un ingreso prolongado en la UCI, lo que da lugar a unos costes mayores del tratamiento en comparación con los otros pacientes de la UCI. Estudios en EE. UU. de los costes de las enfermedades que se centran en los costes directos por paciente de sepsis han arrojado estimaciones de 34.000 €, mientras que los estudios europeos han proporcionado costes estimados menores, oscilando desde los 23.000 € hasta los 29.000 €. No obstante, los costes directos suponen solamente un 20 %-30 % del coste de la enfermedad de la sepsis grave. Los costes indirectos asociados con la sepsis grave corresponden al 70 %-80 % de los costes y surgen principalmente de las pérdidas de productividad debidas a la mortalidad.51
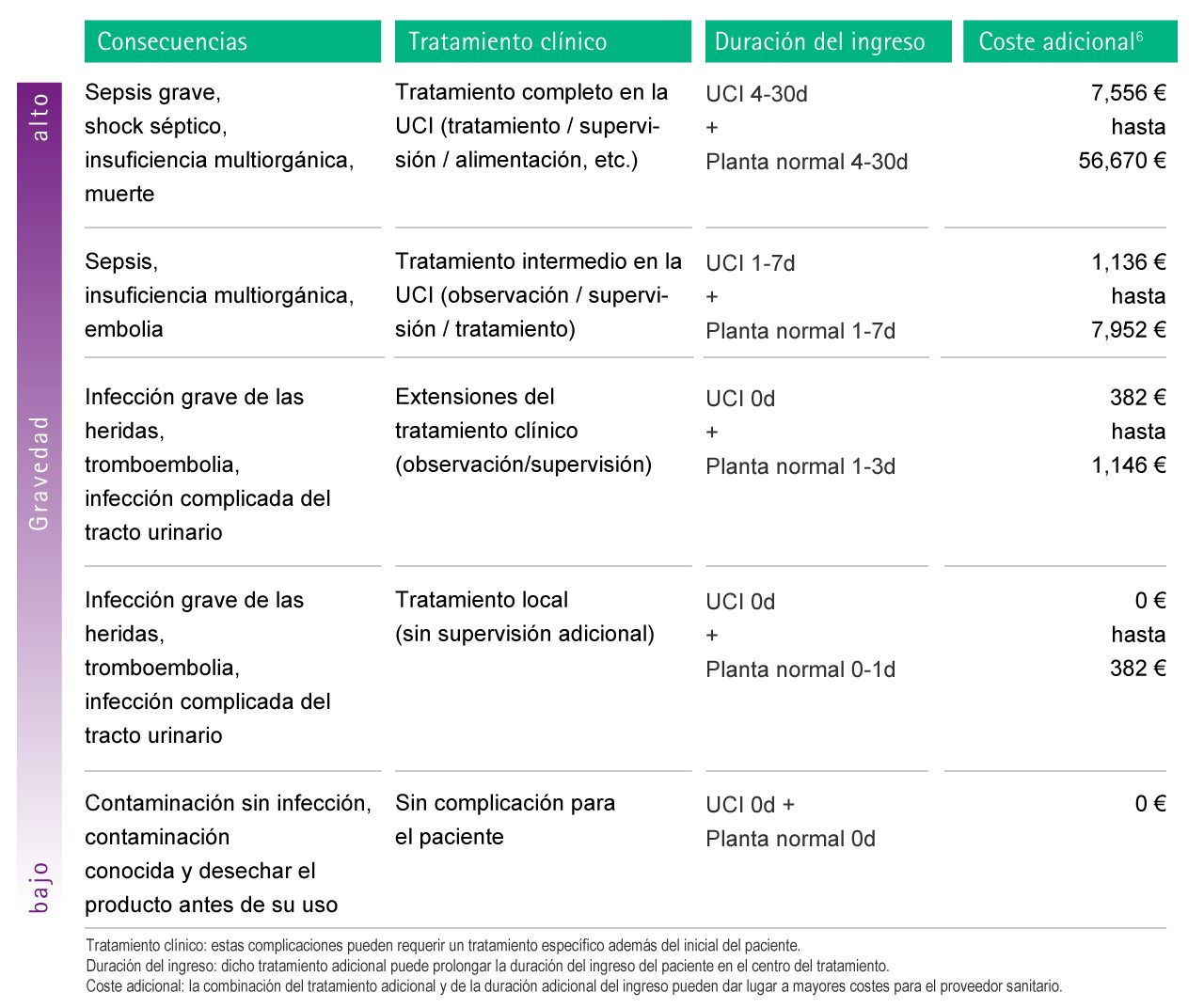
Fig. 4: Estimación de posibles costos adicionales como consecuencia de complicaciones causadas por contaminación microbiológica. Para facilitar la atribución de cada complicación al cálculo del costo, se introdujeron niveles de severidad. UCIR: Unidad de Cuidados Intermedios Respiratorios
La tabla a continuación ofrece una representación esquemática de los costos asociados con las infecciones nosocomiales.52
Estrategias preventivas
La prevención de la contaminación microbiológica, y por tanto, de la infección nosocomial ha adquirido cada vez una mayor importancia y atención durante los últimos años debido a las dramáticas consecuencias para la salud y la economía.
Las sociedades médicas, los hospitales y las agencias gubernamentales han invertido en el desarrollo de directrices basadas en las evidencias para la prevención de las infecciones nosocomiales.3,6,9,10,23,24,25
Educación y formación
La educación adecuada de los trabajadores sanitarios con el conocimiento de los requisitos, las habilidades y las actitudes para unas buenas prácticas de control de las infecciones es la medida más importante para la prevención de las infecciones. Deben proporcionarse programas de sensibilización, formación interna y la formación en el puesto de trabajo con la re-educación periódica de la formación o la orientación del personal. 9,25
Entre todas las medidas, la higiene de las manos tiene el mayor impacto en la prevención de las infecciones, y los guantes, así como otros equipos de seguridad personal, deben usarse siempre (ver figura 8, 9). La OMS y los CDC han lanzado una campaña llamada «Lávese las manos», junto con carteles, formaciones, páginas web y directrices sobre la higiene de las manos.9,26,27,28 La higiene adecuada de las manos corta las tasas de los SARM en un 50%.29
Supervisión y vigilancia
Es muy importante, la implementación de sistemas de vigilancia en las UCI y para otras poblaciones de pacientes en riesgo. Así, es posible determinar las tasas de complicaciones relacionadas con la infusión, seguir las tendencias y corregir las prácticas del control de la infecciones, lo cual ha demostrado tener éxito. P. ej., la estrategia de vigilancia de las infecciones en los Países Bajos fue capaz de reducir la prevalencia de los MRSA por debajo del 1 % de todos los aislados clínicos y, por tanto, es una de las más bajas del mundo. 30,31,32
Soluciones técnicas y de ingeniería
- Uso de materiales estériles y de un solo uso
- Uso de sistemas y dispositivos cerrados que no intercambian aire o contaminantes sin filtrar del entorno adyacente.35
- Uso de apósitos transparentes para fijar los dispositivos de acceso venoso, tanto periféricos como centrales
- Las soluciones intravasculares disponibles comercialmente se fabrican y suministran estériles. La contaminación de soluciones de infusión se produce en raras ocasiones durante el proceso de fabricación28, pero se produce con mayor probabilidad durante la manipulación y la preparación manual en curso6,9,33,34
Manejo
- Todos los envases de soluciones IV deben inspeccionarse con atención en busca de grietas, defectos, turbidez y presencia de partículas en suspensión antes de su preparación y uso.
- Debe utilizarse un catéter nuevo para cada intento de punción.
- Debe realizarse la menor cantidad de manipulaciones posibles sobre los sistemas de infusión puesto que cada manipulación conlleva un riesgo de contaminación.
- Siempre que sea posible, debe usarse el mayor número de barrera preventivas de contaminación.
Productos destacados en seguridad
Evidencia cintífica
1 Ghiglione JF, Martin-Laurent F, Pesce S. (2015) Microbial ecotoxicology: an emerging discipline facing contemporary environmental threats. Environ Sci Pollut Res; DOI 10.1007/s11356-015-5763-1
2 Gabriel J. (2008) Infusion therapy. Part two: Prevention and management of complications. Nurs Stand; 22(32): 41-8
3 World Health Organization 2002
4 Ducel G. Les nouveaux risques infectieux. Futuribles. 1995;203:5–32
5 Guembe M, Martín-Rabadán P, Echenagusia A, Camúñez F, Rodríguez-Rosales G, Simó G, Echenagusia M, Bouza E. (2012) How should long-term tunneled central venous catheters be managed in microbiology laboratories in order to provide an accurate diagnosis of colonization? J Clin Microbiol;50(3):1003-7
6 O‘Grady NP, Alexander M, Dellinger EP, Gerberding JL, Heard SO, Maki DG, Masur H, McCormick RD, Mermel LA, Pearson ML, Raad II, Randolph A, Weinstein RA. 2002
7 European Centre for Disease Prevention and Control. Prevalence of MRSA in Europe 2008
8 Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, Fridkin SK; National Healthcare Safety Network Team; Participating National Healthcare Safety Network Facilities. (2008) NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007. Infect Control Hosp Epidemiol. 2008 Nov;29(11):996-1011
9 Centers for Disease Control and Prevention (CDC)
10 Hebert C, Weber SG. (2011) Common approaches to the control of multidrug-resistant organisms other than methicillin-resistant Staphylococcus aureus (MRSA). Infect Dis Clin North Am. 2011 Mar;25(1):181-200
11 Shah H, Bosch W, Thompson KM, Hellinger WC. (2013) Intravascular catheter-related bloodstream infection. Neurohospitalist; 3(3): 144-51
12 Mermel LA. (2011) What is the predominant source of intravascular catheter infections? Clin Infect Dis. 2011 Jan 15;52(2):211-2
13 Rosado V, Romanelli RM, Camargos PA. (2011) Risk factors and preventive measures for catheter-related bloodstream infections. J Pediatr (Rio J); 87(6): 469-77
14 Jamieson EM, McCall JM, Whyte LA. Practice 21: Intravenous therapy. In: Jamieson EM, McCall JM, Whyte LA. Clinical nursing practices. 5. Edition, Edinburgh [u.a.]: Elsevier Churchill Livingstone 2007; 169-176
15 WHO, 2002, Prevention of hospital-acquired infections. A practical guide. 2nd edition
16 Khan, Hassan Ahmed; Baig, Fatima Kanwal; Mehboob, Riffat (2017): Nosocomial infections. Epidemiology, prevention, control and surveillance. In Asian Pacific Journal of Tropical Biomedicine 7 (5), pp. 478–482. DOI: 10.1016/j.apjtb.2017.01.019
17 Uslusoy E., Mete S. (2008) Predisposing factors to phlebitis in patients with peripheral intravenous catheters: a descriptive study. J Am Acad Nurse Pract; 20(4): 172-80
18 Bouchoucha S, Benghachame F, Trifa M, Saied W, Douira W, Nessib MN, Ghachem MB. (2010) Deep venous thrombosis associated with acute hematogenous osteomyelitis in children. Orthop Traumatol Surg Res; 96(8): 890-3
19 Raad I. (1998) Intravascular-catheter-related infections.Lancet; 351(9106): 893-8.
20 Hanberger H, Walther S, Leone M, Barie PS, Rello J, Lipman J, Marshall JC, Anzueto A, Sakr Y, Pickkers P, Felleiter P, Engoren M, Vincent JL; EPIC II Group of Investigators. (2011) Increased mortality associated with methicillin-resistant Staphylococcus aureus (MRSA) infection in the intensive care unit: results from the EPIC II study. Int J Antimicrob Agents; 38(4): 331-5
21 Rosenthal VD, Maki DG. (2004) Prospective study of the impact of open and closed infusion systems on rates of central venous catheter-associated bacteremia. Am J Infect Control; 32(3): 135-41.
22 Gastmeier P, Geffers C, Brandt C, Zuschneid I, Sohr D, Schwab F, Behnke M, Daschner F, Rüden H. (2006) Effectiveness of a nationwide nosocomial infection surveillance system for reducing nosocomial infections. J Hosp Infect; 64(1): 16-22
23 Zingg W, Holmes A, Dettenkofer M, Goetting T, Secci F, Clack L, Allegranzi B, Magiorakos AP, Pittet D; systematic review and evidence-based guidance on organization of hospital infection control programmes (SIGHT) study group. (2015) Hospital organisation, management, and structure for prevention of health-care-associated infection: a systematic review and expert consensus. Lancet Infect Dis. 2015; 15(2): 212-24
24 Sax H, Clack L, Touveneau S, Jantarada Fda L, Pittet D, Zingg W; PROHIBIT study group. (2013) Implementation of infection control best practice in intensive care units throughout Europe: a mixed-method evaluation study. Implement Sci; 8: 24
25 World Health Organization. 2004
26 Royal College of Nursing (RCN). 2010
27 World Health Organization. 2009 World Health Organization. WHO Guidelines on Hand Hygiene in Health Care. WHO Library Cataloguing-in-Publication Data,
28 MMWR Morbitity and Mortality Weekly Report. 2002 Morbitity and Mortality Weekly Report. Guideline for Hand Hygiene in Health-Care Settings. Recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Recommendations and Reports, Oct 25, 2002, (51) No. RR-16
29 Grayson ML, Jarvie LJ, Martin R, Johnson PD, Jodoin ME, McMullan C, Gregory RH, Bellis K, Cunnington K, Wilson FL, Quin D, Kelly AM, 2008
33 Royal College of Nursing. 2005
34 Scales K. Vascular access: a guide to peripheral venous cannulation. Nurs Stand. 2005; 19(49): 48-52
35 NIOSH. Preventing Occupational Exposures to Antineoplastic and other Hazardous Drugs in Healthcare Settings. 2004
bloodstream infection. International Journal of Antimicrobial Agents 2008; 31: 161-165
52 Plowman RP, Graves N, Robers JA. Hospital Aquired Infection. Office of Health Economics, London 1997